医疗器械ce备案办理流程
医疗器械CE备案办理流程详解
一、引言
对于医疗器械出口企业来说,进行CE备案是非常重要的一环。CE标志是欧洲共同体(European Economic Area)的安全认证标志,表示产品符合欧洲联盟的相关法规和标准要求。本文将详细介绍医疗器械CE备案的办理流程,帮助企业在出口过程中避免不必要的麻烦。
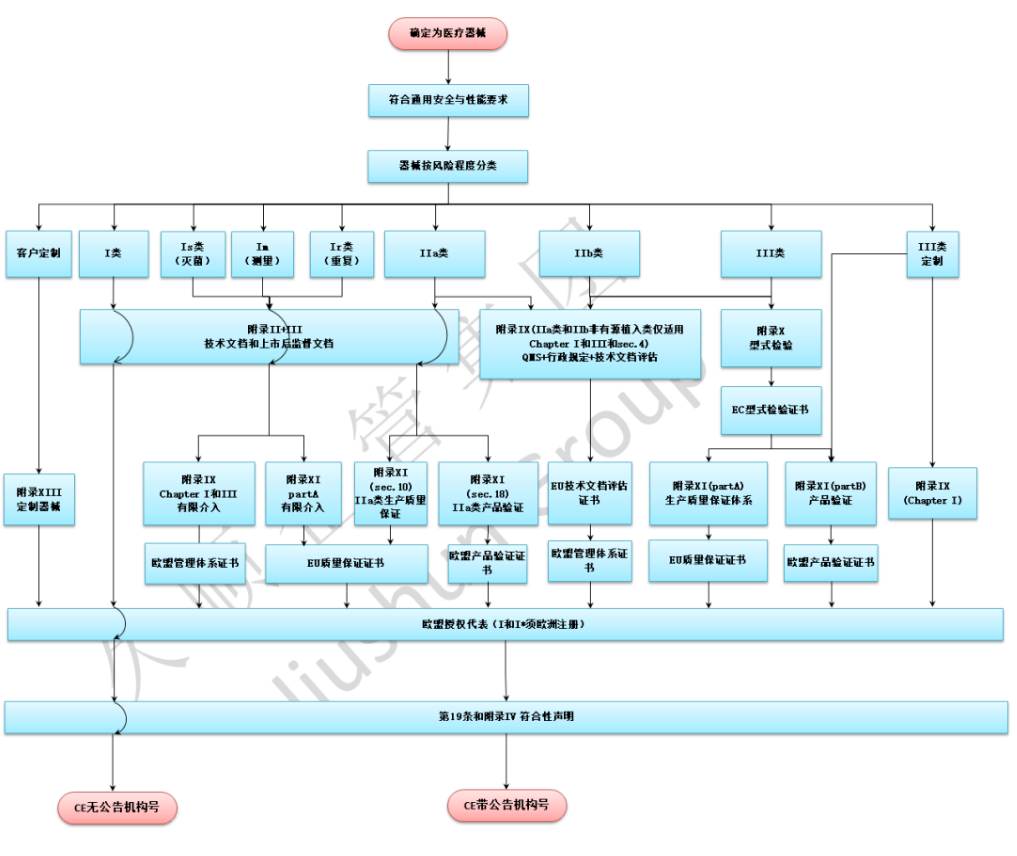
二、办理流程
第一步:了解CE认证要求
首先,企业需要了解欧盟对医疗器械的分类及CE认证的具体要求。不同类型的医疗器械有不同的认证标准,企业应明确自家产品所属类别。

第二步:准备技术文档
企业需要准备产品的技术文档,包括产品说明书、技术规格、工艺流程等。这些文档是评估产品是否符合CE标准的重要依据。

第三步:选择合适的认证机构
根据企业实际情况和产品特性,选择合适的第三方认证机构进行认证申请。企业应选择有资质、经验丰富的机构以确保认证过程的顺利进行。
第四步:提交申请并等待评估
提交产品认证申请后,认证机构将对产品进行评估。评估过程可能包括产品测试、文件审核等环节。企业需要耐心等待评估结果。
第五步:获得CE证书
若产品顺利通过评估,企业将获得CE证书。此证书是产品可以在欧盟市场合法销售的重要凭证。
第六步:进行CE备案
企业获得CE证书后,需要在欧盟官方指定的平台进行备案。备案过程中需提交产品相关信息及证书等材料。备案完成后,企业即可在欧盟市场销售产品。
三、注意事项
- 企业应确保提交的技术文档真实、准确,否则可能导致认证失败或面临法律纠纷。
- 选择合适的认证机构和备案平台非常重要,直接影响认证过程和结果。企业应选择有资质、信誉良好的机构进行合作。此外,还需关注欧盟的最新法规和标准动态,确保产品持续符合CE认证要求。总之,办理医疗器械CE备案是一个复杂的过程,企业需要充分了解相关法规和标准,选择合适的合作伙伴,确保产品的合规性和市场竞争力。


























