办理医疗器械ce备案流程
办理医疗器械CE备案流程
一、引言
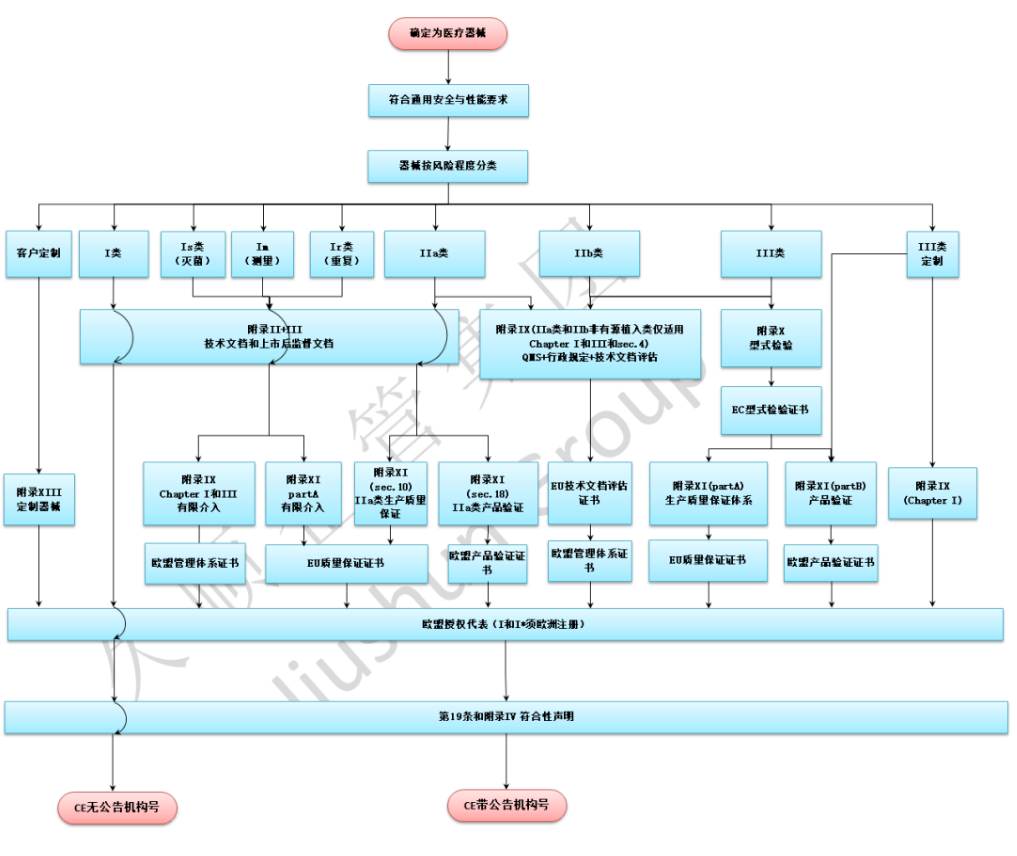
医疗器械在欧盟市场的销售需要符合相关法规要求,其中CE认证是医疗器械进入欧洲市场的必要认证之一。本文将详细介绍办理医疗器械CE备案的流程。

二、办理流程
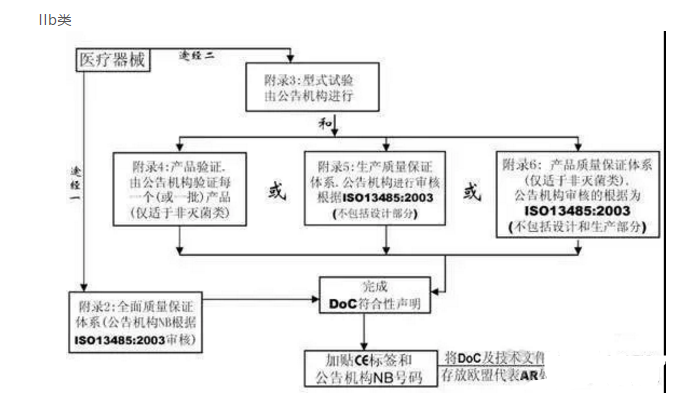
-
准备阶段
在准备申请CE认证前,首先需要确保医疗器械符合欧盟的相关法规和标准。接着,需要收集并整理产品技术文件,包括产品说明书、技术规格、设计文件等。同时,还需确定产品的分类和适用的法规要求。
-
申请阶段
向欧盟成员国指定的公告机构提交申请,填写申请表格并提交产品技术文件。申请表格应包括企业的基本信息、产品的基本信息以及选择的认证路径等。
-
评估阶段
公告机构将对提交的产品技术文件进行评估和审核。评估可能包括产品检验、现场审核等方式。评估周期视产品和公告机构的工作量而定。
-
备案阶段
完成评估后,若产品符合CE认证要求,公告机构将颁发CE证书。企业需将证书及相关技术文件提交至欧盟成员国指定的监管机构进行备案。
-
监管阶段
备案完成后,企业需按照欧盟法规的要求进行产品的生产、销售和使用。监管机构可能会对产品进行监督和检查,确保产品持续符合法规要求。
三、注意事项
- 在办理过程中,企业应确保产品的安全性和有效性;
- 提交的技术文件应真实、准确、完整;
- 选择合适的公告机构和认证路径;
- 及时了解欧盟法规的动态变化,确保产品持续符合法规要求。
四、结语
办理医疗器械CE备案是一个复杂的过程,需要企业充分了解欧盟法规要求,并按照流程逐步完成。通过本文的介绍,希望能为企业在办理医疗器械CE备案时提供有益的参考。


























